Women's Wellness Fitness Open Class | Siberian Power Show 2020
Obrovské zprávy, D-přátelé: nový inzulín s rychlým účinkem, známý jako Afrezza, právě získal souhlas FDA!
Třetí dobou je kouzlo této nové formulace inhalovatelného inzulínu, druhá - kdykoliv se to podaří regulačnímu procesu Spojeného království poté, co Pfizer ztroskotala Exuberovu lépe před deseti lety.
V pátek Kalifornská biotechnologická společnost MannKind Corp. konečně získala regulační povolení pro svůj přístroj Afrezza.

Nyní, po opětovném odeslání společnosti Afrezza v říjnu 2013, MannKind konečně přesvědčil FDA, že je připraven dostat se do rukou dospělých s diabetem!
Vedoucí pracovníci společnosti MannKind nám říkali, že pracují na nalezení farmaceutického partnera k výrobě a distribuci přípravku Afrezza a výrobek by mohl být k dispozici již v lednu nebo do konce prvního čtvrtletí roku 2015. > V tiskové zprávě FDA vydané v pátek Dr. Jean-Marc Guettier z oddělení agentury pro metabolismus a endokrinologické léčivé přípravky uvádí: "Současné schválení rozšiřuje možnosti dostupnosti jídelního inzulínu v celkovém řízení pacientů s diabetem, kteří je potřebují ke kontrole hladiny cukru v krvi. "
Zde je 411 na Afrezza, pro ty, kteří nevědí:Afrezza je inzulin s ultrarapidním účinkem v práškové formě, který je navržen jako inzulín před dospělým jídlem pro dospělé ) s diabetem typu 1 nebo typu 2. Je zaměřen na hroty krevního cukru po jídle, což znamená, že se používají při léčbě inzulinem a nejsou určeny k samostatné léčbě inzulínem.
Práškový inzulín je podáván prostřednictvím inhalátoru s velikostí píšťaly nazývaného Dreamboat, který byl vyvinut po prvním kole FDA a způsobil zpoždění, protože agentura chtěla používat klinické studie s použitím nového inhalátoru. Prášek se okamžitě rozpouští, když se vdechne do plic a inzulín se pak rychle dostane do krevního oběhu, aby začal pracovat. Afrezza vrcholí během 12 až 15 minut a je mimo systém za hodinu ve srovnání se současnými krátkodobými inzulínovými léky, které obvykle trvají nejméně 20 minut, aby vstřelily, vrchol po 2-3 hodinách a mohou zůstat v systému tak dlouho, dlouhá až pět hodin.
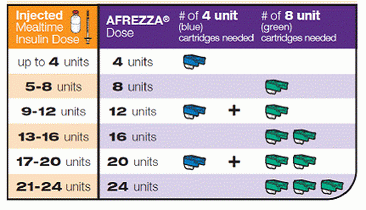
Největší přitažlivost je samozřejmě, že nevyžaduje žádné jehly, ale jen malý ruční inhalátor, který opravdu vypadá jako píšťalka.Dreamboat je určen k odhození po 15 dnech, aby se zabránilo tvorbě prášků uvnitř, které by mohly ucpat zařízení. Na rozdíl od tradičního inzulínu nepotřebuje žádné chlazení, ale spíše se udržuje při pokojové teplotě. Každá kazeta pro jedno použití by měla mít buď 4 nebo 8 jednotek a v době, kdy je Afrezza komerčně dostupná, mohla být dostupná kazeta s 12 jednotkami.
Zde je, jak byste mohl dávkovat, přeměnit současnou injekci inzulínu nebo množství bolusu do inhalovatelné dávky, která by byla vstřícná Afrezze:
Osobně to nevypadá jako hodně inzulínu, aby pokrylo některé jídla, které jí vyžadují vyšší dávky … budu procházet celou skupinou těch malých kazet. Takže u některých zařízení PWD může toto zařízení představovat logistickou výzvu, pokud jde o snadné dávkování množství, které potřebujeme …? Ale opět to může být dobrý nástroj pro potlačení tvrdohlavých cukrů s vysokým obsahem kyseliny krevní s korekcí dávkování.
V telefonickém rozhovoru v pátek v pátek, MannKind prezident Hakan Edstrom nám řekl, že společnost dosud neuzavřela žádné dohody s potenciálními partnery za účelem výrobce a distribuce Afrezza. Ale blíží se a v rozhovorech s řadou společností, aby co nejdříve dokončili partnerství.
Náklady zůstávají na TBD (hodně závisí na potenciálním partnerství), ale Edstrom říká, že očekávají, že ceny budou ve stejném rozsahu jako to, co my pacient obvykle platí za inzulínové pera v USAToto schválení je obrovským vývojem, a to už je dlouhá doba, osm let od doby, kdy toto hledání začalo Alfred Mann - muž, který založil společnost Minimed předtím, než jej nakonec koupila společnost Medtronic. Sledujeme příběh Afrezzy už léta na dolu "
Mine - od počátečních dnů podání FDA, kdy měl MannKind svůj původní křehký design, na novější pokrytí toho, jak se Afrezza používá v umělé pankreatu klinické testy.
Před opětovným podáním FDA v loňském roce jsme slyšeli, že MannKind se chlubí svých klinických studií fáze III v loňském létě, které zahrnovalo 500 a více typů PWD v USA a celosvětově, což naznačovalo, že společnost je připravena znovu vyzkoušet si ruku s FDA.
Poradní výbor, který se scházel dne 1. dubna tohoto roku, hlasoval 13 na 1, že Afrezza byla bezpečná a dostatečně účinná k tomu, aby byla schválena jako léčba diabetu 1. typu, s tím, že jediný oponent David Cooke hlasoval, že rizika převažují nad přínosy pro typ 1s.Poukázal na interní přehled FDA, který ukázal, že někteří pacienti, kteří užívali přípravek Afrezza, zastavili léčbu po vývoje bronchiálních křečí, kašli a poklesu funkce plic. Ale žádný z těchto obav nevznikl při hlasování o Afresze pro použití typu 2 a výbor jednomyslně rozhodl o hlasování 14-0.

Nedoporučuje se u diabetiků, kteří kouří, ani při léčbě diabetické ketoacidózy (DKA).
Afrezza je schválena pouze pro dospělé, ne pro děti. Agentura však požaduje klinické hodnocení po uvedení přípravku na trh s cílem zhodnotit bezpečnost a použití u pediatrických pacientů.
- FDA požaduje varování před boxem a upozorňuje, že někteří lidé s astmatem a chronickou obstrukční plicní chorobou (COPD), kteří užívali Afrezzu, měli akutní bronchospazmus. V důsledku toho by pacienti s chronickým onemocněním plic, astmatem nebo CHOPN neměli užívat Afrezzu kvůli tomuto riziku. Mezi nejčastější nežádoucí účinky spojené s přípravkem Afrezza v klinických studiích byly hypoglykemie, kašel a bolest nebo podráždění krku.
- Součástí požadavků na schválení je strategie hodnocení a zmírňování rizik, která musí obsahovat komunikační plán, který informuje zdravotnické pracovníky o závažném riziku akutního bronchospasmu spojeného s přípravkem Afrezza. To znamená zabezpečit, aby přínosy převažovaly nad možnými riziky používání přípravku Afrezza.
- U přípravku Afrezza jsou vyžadovány další studie po uvedení přípravku na trh, jako je: klinické hodnocení k posouzení potenciálního rizika plicní malignity při použití (tato studie rovněž posuzuje kardiovaskulární riziko a dlouhodobý účinek přípravku Afrezza na funkci plic); a dvě farmakokineticky-farmakodynamické euglykemické klešťové klešťové klinické studie, jedna pro charakterizaci odpovědi na dávku a druhá pro charakterizaci variability v rámci subjektu.
- Edstrom nám řekl, že plánuje zahájení pediatrických studií co nejdříve, což bude reálně začát někdy v polovině roku 2015. To znamená, že společnost Afrezza by mohla být schválena pro děti s diabetem až do roku 2017 a tento regulační proces se může lišit v závislosti na tom, co mezitím prokazují postmarketingové studie a zkušenosti s užíváním dospělých.
- A přes FDA zelené světlo, neexistuje žádná záruka Afrezza uvidí komerční úspěch nebo že PWD se budou hýbat používat. Jak již bylo řečeno, MannKind ještě nezajistil žádné farmaceutické partnery, kteří by byli ochotni prodat Afrezzu. Pokud však výdělky MannKindových v květnu naznačují, co se blíží, potenciální partnerství nemusí být daleko.
Z pohledu investora je mnoho lidí skeptičtí na základě neúspěšného inzulovaného inzulínu Exubera, který během posledních několika let formoval většinu diskuse o Afrezze. Tento společný výrobek společnosti Pfizer-Sanofi byl v roce 2007 vyřazen z trhu po více než jednomesátním prodeji, což mělo za následek rekordní 2 dolary. 8 miliard ztrát pro prodejce.
Samozřejmě, MannKind tvrdí, že Afrezza je výrazně odlišná, hlavně proto, že Exubera používala neohrabaně dlouhý inhalátor a byla spojena s vyšším rizikem rakoviny plic, které Pfizer prostě nedokázal překonat.
Uvidíme, co D-komunita nyní u Afrezzy myslí, a to zejména se všemi pozornostmi klinické studie AP, které se objevily nedávno. Ať už je to dost, abyste přesvědčili masy, je dosud nejasné …
Nyní zasuňte zprávu a uvidíme, jak dlouho trvá, než nás všichni vydechneme a změníme toto vzrušení na skutečný prodej a rozšířené využití.
Odmítnutí odpovědnosti
: Obsah vytvořený týmem Diabetes Mine. Pro více informací klikněte zde.
Odmítnutí odpovědnosti Tento obsah je vytvořen pro Diabetes Mine, blog pro zdraví spotřebitelů zaměřený na diabetickou komunitu. Obsah není lékařsky přezkoumáván a nedodržuje redakční pokyny společnosti Healthline. Více informací o partnerství Healthline s Diabetes Mine naleznete zde.Inhalovaný přípravek Insulin Afrezza byl schválen FDA

FDA schválil nový inhalovaný inzulínový přípravek. Afrezza je inzulin s ultrarapidovým účinkem v práškové formě, který je určen jako předkrm pro diabetiky 1. typu.
Inhalovaný inzulin Schváleno FDA: Mluvení pro OC?

Afrezza, afrezza 4 jednotka (30) - 8 jednotka (60), afrezza 4 jednotka (60) - 8 jednotka (30) (inzulín (inhalace)) vedlejší účinky, interakce, použití a otisk léčiva

Informace o drogách na Afrezze, Afrezza 4 jednotce (30) - 8 jednotce (60), Afrezza 4 jednotce (60) - 8 jednotce (30) (inzulín (inhalace)) zahrnuje obrázky drog, vedlejší účinky, lékové interakce, návod k použití, příznaky předávkování a čemu se vyvarovat.




